Equilíbrio Ácido-Básico
MAPA CONCEITUAL!
Andressa Garcia, Bruna Brantes e Geovanna C. Mariosi da Silva, 2 de agosto de 2019 - 17:32
Oi, pessoal!
Hoje trazemos a vocês um mapa conceitual, uma maneira de esquematizar o conteúdo principal do tema Equilíbrio Ácido-Básico, que abordamos aqui no blog, como mais uma ferramenta pra vocês revisarem todo o aprendizado.
Se não entenderem algo, escrevam pra gente que tiramos as dúvidas!
Abraços metabólicos, e até mais!
__________
ALERTA VÍDEO!
Andressa Garcia, Bruna Brantes e Geovanna C. Mariosi da Silva, 2 de agosto de 2019 - 17:32
Oi, pessoal!
Hoje trazemos a vocês um mapa conceitual, uma maneira de esquematizar o conteúdo principal do tema Equilíbrio Ácido-Básico, que abordamos aqui no blog, como mais uma ferramenta pra vocês revisarem todo o aprendizado.
Se não entenderem algo, escrevam pra gente que tiramos as dúvidas!
Abraços metabólicos, e até mais!
__________
QUIZZ! PARTE 2
EQUILÍBRIO ÁCIDO-BÁSICO
Andressa Garcia, Bruna Brantes e Geovanna C. Mariosi da Silva, 2 de agosto de 2019 - 16:50
Olá, pessoal! Estamos aqui, novamente, com a segunda parte do QUIZZ que prometemos! Mais seis questões pra você testar seus conhecimentos sobre Equilíbrio Ácido-Básico. Vamos lá?
1. Se uma pessoa estiver como pH= 7,52; pCO2 = 30 mmHg; HCO3- = 24 mEq/ l significa?
A) Alcalose, a pCO2 diminuição de ácidos pela via respiratória e o HCO3- está normal. Portanto tem-se uma alcalose respiratória.
B) Alcalose, a pCO2 aumentado pela via respiratória, HCO3- diminuído significa excesso de ácidos pela via metabólica. Portanto uma alcalose respiratória.
C) Acidose, a pCO2 aumento de ácidos pela via respiratória e o HCO3- diminuição de ácidos pela via metabólica. Portanto, uma acidose respiratória.
D) Acidose, a pCO2 aumento de ácidos pela via respiratória e o HCO3-
diminuição de ácidos pela via metabólica. Portanto, uma alcalose metabólica.
2. Sobre gasometria arterial e equilíbrio ácido-base responda a alternativa correta:
A) Somente PO2 varia com hipoventilação e não pH.
B)Acidose mista compensada pode ser compensada por qualquer um dos dois fatores.
C) Acidose metabólica apresenta HCO3 abaixo do normal.
D) Acidose respiratória com hipoxemia apresenta pH com valores acima do normal.
3. Calcule o pH das seguintes soluções:
a) HBr 1,0 x 10-3 mol/L
b) HNO3 2,0 x 10-9 mol/L
c) KOH 3,0 x 10-3 mol/L
d) NaOH 4,0 x 10-9 mol/L
4. O pH de uma solução-tampão formada pela mistura de solução com 0,1 mol . L-1 de ácido acético e solução com 0,5 mol . L-1 de acetato de sódio é: Ka do ácido acético = 1,8 . 10-5;
A) 4,45
B) 4,75
C) 5,00
D) 5,45
E) 5,95
5. (UFSCar-SP) O pH do sangue humano de um indivíduo saudável situa-se na faixa de 7,35 a 7,45. Para manter essa faixa de pH, o organismo utiliza vários tampões, sendo que o principal tampão do plasma sanguíneo consiste de ácido carbônico e íon bicarbonato. A concentração de íons bicarbonato é aproximadamente vinte vezes maior que a concentração de ácido carbônico, com a maior parte do ácido na forma de CO dissolvido. O equilíbrio químico desse tampão pode ser representado pela equação:
CO2(g) + H2O(l) ↔ H2CO3(aq) ↔ H+(aq) + HCO-3(aq)
Analise as afirmações seguintes:
I. Quando uma pequena quantidade de base entra em contato com uma solução-tampão, os íons hidróxido reagem com o ácido do tampão, não alterando praticamente o pH dessa solução.
II. Quando a concentração de íons bicarbonato no sangue aumenta, o pH também aumenta.
III. Quando a concentração de CO2 no sangue aumenta, o pH diminui.
São corretas as afirmações:
A) I, apenas.
B) II, apenas.
C) III, apenas.
D) I e II, apenas.
E) I, II e III
6.Quais dos reguladores demora vários dias para se ajustar o equilíbrio ácido-básico?
A) Sistema tampão
B) Regulação respiratória
C) Regulação renal
Olá, pessoal! Estamos aqui, novamente, com a segunda parte do QUIZZ que prometemos! Mais seis questões pra você testar seus conhecimentos sobre Equilíbrio Ácido-Básico. Vamos lá?
1. Se uma pessoa estiver como pH= 7,52; pCO2 = 30 mmHg; HCO3- = 24 mEq/ l significa?
A) Alcalose, a pCO2 diminuição de ácidos pela via respiratória e o HCO3- está normal. Portanto tem-se uma alcalose respiratória.
B) Alcalose, a pCO2 aumentado pela via respiratória, HCO3- diminuído significa excesso de ácidos pela via metabólica. Portanto uma alcalose respiratória.
C) Acidose, a pCO2 aumento de ácidos pela via respiratória e o HCO3- diminuição de ácidos pela via metabólica. Portanto, uma acidose respiratória.
D) Acidose, a pCO2 aumento de ácidos pela via respiratória e o HCO3-
diminuição de ácidos pela via metabólica. Portanto, uma alcalose metabólica.
2. Sobre gasometria arterial e equilíbrio ácido-base responda a alternativa correta:
A) Somente PO2 varia com hipoventilação e não pH.
B)Acidose mista compensada pode ser compensada por qualquer um dos dois fatores.
C) Acidose metabólica apresenta HCO3 abaixo do normal.
D) Acidose respiratória com hipoxemia apresenta pH com valores acima do normal.
3. Calcule o pH das seguintes soluções:
a) HBr 1,0 x 10-3 mol/L
b) HNO3 2,0 x 10-9 mol/L
c) KOH 3,0 x 10-3 mol/L
d) NaOH 4,0 x 10-9 mol/L
4. O pH de uma solução-tampão formada pela mistura de solução com 0,1 mol . L-1 de ácido acético e solução com 0,5 mol . L-1 de acetato de sódio é: Ka do ácido acético = 1,8 . 10-5;
A) 4,45
B) 4,75
C) 5,00
D) 5,45
E) 5,95
5. (UFSCar-SP) O pH do sangue humano de um indivíduo saudável situa-se na faixa de 7,35 a 7,45. Para manter essa faixa de pH, o organismo utiliza vários tampões, sendo que o principal tampão do plasma sanguíneo consiste de ácido carbônico e íon bicarbonato. A concentração de íons bicarbonato é aproximadamente vinte vezes maior que a concentração de ácido carbônico, com a maior parte do ácido na forma de CO dissolvido. O equilíbrio químico desse tampão pode ser representado pela equação:
CO2(g) + H2O(l) ↔ H2CO3(aq) ↔ H+(aq) + HCO-3(aq)
Analise as afirmações seguintes:
I. Quando uma pequena quantidade de base entra em contato com uma solução-tampão, os íons hidróxido reagem com o ácido do tampão, não alterando praticamente o pH dessa solução.
II. Quando a concentração de íons bicarbonato no sangue aumenta, o pH também aumenta.
III. Quando a concentração de CO2 no sangue aumenta, o pH diminui.
São corretas as afirmações:
A) I, apenas.
B) II, apenas.
C) III, apenas.
D) I e II, apenas.
E) I, II e III
6.Quais dos reguladores demora vários dias para se ajustar o equilíbrio ácido-básico?
A) Sistema tampão
B) Regulação respiratória
C) Regulação renal
GABARITO
1. A
2. C
3. a) pH = 3,00 b) pH = 6,996 ≈ 7,00 c) pH = 11,48 d) pH = 7,01
4. H = pKa + log [sal]
[ácido]
pH = - log (1,8 . 10-5) + log 0,5
0,1
pH = - log (1,8) - log (10-5) + log 5
pH = - 0,25 -(-5) + 0,7
pH = - 0,25 + 5 + 0,7
pH = 5,45
5. E
6. C
__________1. A
2. C
3. a) pH = 3,00 b) pH = 6,996 ≈ 7,00 c) pH = 11,48 d) pH = 7,01
4. H = pKa + log [sal]
[ácido]
pH = - log (1,8 . 10-5) + log 0,5
0,1
pH = - log (1,8) - log (10-5) + log 5
pH = - 0,25 -(-5) + 0,7
pH = - 0,25 + 5 + 0,7
pH = 5,45
5. E
6. C
ALERTA VÍDEO!
O QUE É ACIDOSE METABÓLICA?
Andressa Garcia, 2 de agosto de 2019 - 15:31
Este vídeo é um adequado recurso para garantir as informações de uma abordagem mais clínica e uma linguagem mais didática sobre o tema de acidose metabólica, assim fornecendo informações sobre o diagnóstico, tratamento, efeitos colaterais e efeitos psicossociais.
Andressa Garcia, 2 de agosto de 2019 - 15:31
Este vídeo é um adequado recurso para garantir as informações de uma abordagem mais clínica e uma linguagem mais didática sobre o tema de acidose metabólica, assim fornecendo informações sobre o diagnóstico, tratamento, efeitos colaterais e efeitos psicossociais.
__________
INTERESSANTE!
O QUE É GASOMETRIA ARTERIAL?
Andressa Garcia, 2 de agosto de 2019 - 14:02
ALERTA ARTIGO!
ABORDAGEM CLÍNICA DOS DISTÚRBIOS DO EQUILÍBRIO ÁCIDO-BÁSICO
Andressa Garcia, 2 de agosto de 2019 - 12:50
Clique aqui para acessar o link do artigo!
__________
INTERESSANTE - VÍDEO!
Andressa Garcia, 2 de agosto de 2019 - 14:02
Neste site vemos a importância de se realizar o exame da gasometria, que é um exame para avaliar a oxigenação no corpo e os níveis de ph, o CO2 e a saturação de O2 que apresentamos comesses resultamos vemos o equilíbrio ácido-básico no sangue, e toda uma breve explicação bem didática sobre a realização do exame e os resultados obtidos para saber mais, clique aqui!
__________
ALERTA VÍDEO!
EQUILÍBRIO ÁCIDO-BÁSICO NA LOUSA!
EQUILÍBRIO ÁCIDO-BÁSICO NA LOUSA!
Geovanna C. Mariosi da Silva, 2 de agosto de 2019 - 13:23
Oi, pessoal! Hoje trouxe um vídeo pra vocês do professor Fernando Mafra, ele tem um canal no YouTube, em que uma das modalidades de vídeo é o quadro "Na Lousa", em que ele explica os principais conceitos do conteúdo de maneira simples e didática. Vale a pena conferir!
CURIOSIDADES!
COMO AS PESSOAS VIVEM EM ALTAS ALTITUDES?
Bruna Brantes, 2 de agosto de 2019 - 13:05

Oi, pessoal! Hoje trouxe um vídeo pra vocês do professor Fernando Mafra, ele tem um canal no YouTube, em que uma das modalidades de vídeo é o quadro "Na Lousa", em que ele explica os principais conceitos do conteúdo de maneira simples e didática. Vale a pena conferir!
Abraços metabólicos, e até mais!
__________
COMO AS PESSOAS VIVEM EM ALTAS ALTITUDES?
Bruna Brantes, 2 de agosto de 2019 - 13:05
Ao subirmos um morro, com uma altitude um pouco acima do nível do mar, nós já notamos uma dificuldade de respirar, agora imaginem os indivíduos que vivem nos

Andes e no Himalaia, situados em altitudes acima de 3.965 metros, por exemplo.
Muitos deles nasceram nesses locais e lá vivem por toda sua vida. Nesse caso a aclimatação começa desde a infância nos nativos. Essas pessoas têm o seu tórax aumentado, o tamanho do corpo diminuído e o coração – principalmente o lado direito – muito expandido. Características estas – especialmente o tórax e o coração aumentados – decorrentes principalmente do aumento do trabalho dos músculos envolvidos na respiração e do bombeamento do coração a fim de compensar a rarefação. A disponibilidade do oxigênio pelo sangue aos tecidos é muito facilitada. Essas modificações ao longo da vida dos nativos permitem que eles consigam viver e não apenas sobreviver em lugares altíssimos.
Mas agora quer saber como o SEU corpo reagiria, aclimataria e quais seriam as consequências disso em altas altitudes? Clique AQUI e leia mais sobre a fisiologia das altas altitudes.
__________
ALERTA ARTIGO!
ABORDAGEM CLÍNICA DOS DISTÚRBIOS DO EQUILÍBRIO ÁCIDO-BÁSICO
Andressa Garcia, 2 de agosto de 2019 - 12:50
Fazendo uma análise laboratorial sobre os diferentes distúrbios do equilíbrio ácido-básico que podemos apresentar em nosso corpo, realizando explicação do conteúdo do equilíbrio ácido-básico de uma forma clinico-laboratorial dos distúrbios associados a este tema. De uma forma simples de como acidose e alcalose, tanto metálica quanto respiratória agem nos nossos sistemas, o diagnóstico, como diagnosticar esses distúrbios e o tratamento correto para cada um deles. Por fim o artigo autor nos traz casos clínicos de para melhor exemplificar a diversos distúrbios.
Clique aqui para acessar o link do artigo!
__________
INTERESSANTE - VÍDEO!
VOCÊ SABE O QUE É ANION GAP?
Bruna Brantes, 1 de agosto de 2019 - 22:30
Bruna Brantes, 1 de agosto de 2019 - 22:30
Intervalo aniônico ou anion gap é a diferença entre os cátions presentes no sangue (sódio) e os ânions (bicarbonato e cloro). Para que a eletroneutralidade do organismo seja mantida, a soma de todos os cátions do nosso corpo deve ser igual a soma de todos os ânions. O principal cátion do organismo é o sódio e os principais ânions são o bicarbonato e o cloro.
Considerasse o valor normal de sódio no plasma sendo 140 meq/l, o de cloro de 105 meq/l e bicarbonato de 24 meq/l. Pelo princípio da eletroneutralidade, a soma dos cátions deve ser igual ao somatório dos ânions, porém, a soma do cloro com o bicarbonato não se iguala ao valor do sódio, faltado 11 unidades para isso. Essas 11 unidades faltantes são os ânions não mensuráveis, ou seja, não medidos pelos exames de sangue de rotina.
Considera-se o valor normal de anion gap entre 12 +/- 4 mEq/L.
Para entender melhor sobre o assunto, sugiro que assistam o video a seguir, do canal Osmosis.org, sobre os anions gap e como funciona a eletroneutralidade do nosso organismo.
Aproveitem!
__________
ALERTA ARTIGO!
VOCÊ JÁ OUVIU FALAR NO MÉTODO DE STEWART-FENCL-FIGGE?
Bruna Brantes, 1 de agosto de 2019 - 21:05
Tradicionalmente, os distúrbios ácido-básicos são explicados através do sistema ácido carbônico-bicarbonato. Essa relação é descrita através da equação de Henderson-Hasselbalch. Porém, este método, falha em explicar os prováveis mecanismos causais nos extremos dos distúrbios fisiológicos. Por isso, diversos estudos têm sido feitos na tentativa de encontrar novos métodos para aprimorar a interpretação dos distúrbios ácido-básicos. O cálculo da diferença de íons fortes é um desses métodos. Como suas variáveis são matematicamente válidas isto provê maior utilização clínica do que parâmetros como excesso de base e aníon gap. Por estas razões, o método de Stewart, não muito utilizado na prática clínica por ser uma equação matemática complexa, vem ganhando popularidade nas unidades de terapia intensiva. O problema das equações matemáticas pode ser facilmente resolvido através de programas de computadores. Com isto, seu uso poderá ser instituído permitindo melhor avaliação dos pacientes com distúrbios ácido-básicos e múltiplas disfunções orgânicas. Recentemente, tem-se mostrado que o método tradicional associado ao AG corrigido pela albumina e pelo lactato é tão eficiente em identificar a presença de ânions não mensurados no paciente criticamente enfermo quanto o método de Stewart.
Para conhecer um pouco mais sobre esse método e comparar com a abordagem tradicional de Henderson-Hasselbalch, acesse o artigo por AQUI.
__________
CURIOSIDADES!
Seja por desejo de praticar medicina, curiosidade sobre o corpo humano e seu funcionamento, ou simplesmente por gostar da trama, seriados médicos sempre prendem a atenção e ganham o coração do telespectador.
Dentre todas essas superproduções, citarei dois exemplos conhecidos - e meus favoritos: Grey’s Anatomy e Dr House.
Mas aí você me pergunta: o que isso tem a ver com o nosso tema: equilíbrio ácido-básico? E eu te respondo: TUDO!
Nas postagens anteriores, discutimos sobre distúrbios ácido-básico, entre eles a acidose. Acidose essa que faz parte do que os médicos chamam de “Tríade da morte”.
No episódio 05 da temporada 11 de Grey’s Anatomy, a narração do episódio começa fazendo menção a essa tríade e o quão difícil é resolve-la:

“Uncontrollable bleeding, acidosis, cold. We all know what the combination means. We call it the triad of death. The point of no return. It’s the moment in the O.R. where we turn to damage control. You stop. You step back. You let the body rest and see if you can find a solution to the chaos that’s happening inside … Once the chaos subsides, we have to go back, take another look. We have to ask ourselves, ‘Can this body be put back together?’ If we’ve done our jobs right, it can. We stop the bleed. We sow the damage. We make the body whole again. But no matter how hard we try, we have to realize some things just can’t be fixed.”
Outro episódio que também trata de uma acidose, é o episódio 19 da temporada 12, a partir do minuto 23, um dos médicos da série narra tudo o que fez – infelizmente não foi suficiente - para salvar um bebe que estava em acidose metabólica:
“- The baby was in respiratory failure despite maximal ventilatory support. He fit the criteria, so ECMO was the only option. What was his oxygenation index? Around 45 for at least 20 minutes. And you used aggressive resuscitation? Yeah, of course. They tried to clear his metabolic acidosis with fluids, but he had a pH of I mean, I can pull the chart.”
Além desses, muitos outros episodios tratam de temas vistos nesse blog, ou seja, é pegar a pipoca e se divertir enquanto aprende!
AULA!
EQUILÍBRIO ÁCIDO-BÁSICO
Andressa Garcia, Bruna Brantes e Geovanna C. Mariosi da Silva, 30 de julho de 2019 - 17h10
Disponibilizamos aqui a aula apresentada na disciplina de Biofísica, esperamos que seja útil, e se houver alguma dúvida, entrem em contato com a gente!
Aula de Equilíbrio Ácido-Básico
E até mais!
__________
INTERESSANTE!
POR QUE SENTIMOS SONO APÓS O ALMOÇO?
Bruna Brantes, 27 de julho de 2019 - 19:28
Sabe aquele soninho que sentimos logo após uma refeição? Então, isso acontece porque durante a digestão, o estômago captura água e gás carbônico no organismo para formar o ácido carbônico. Esse ácido reage com outro, o ácido clorídrico, e forma o suco gástrico, que digere os alimentos. Para aumentar a sua produção é necessário retirar íons H+ do sangue. É essa retirada de íons do sangue que provoca a chamada sonolência após as refeições.
Além disso, após a digestão gera-se muito bicarbonato de sódio, que diminui a atividade de alerta do cérebro. Esse sono é denominado cientificamente alcalose pós-prandial.
Outros fatores que causam a sonolência é a falta de oxigenação no cérebro, pois o sangue fica concentrado na área do aparelho digestivo; assim, a oferta de oxigênio para o cérebro diminui e sua atividade também, além de diminuir a irrigação do sistema nervoso, o que diminui a capacidade de concentração e a força dos músculos.
Referências Bibliográficas:
https://super.abril.com.br/comportamento/sangue-menos-acido-da-sono-depois-do-almoco/
https://alunosonline.uol.com.br/quimica/sono-apos-almoco.html
https://alimentacaoemfoco.org.br/sono-depois-do-almoco/
__________QUIZZ!
EQUILÍBRIO ÁCIDO-BÁSICO
Andressa Garcia, Bruna Brantes e Geovanna C. Mariosi da Silva, 27 de julho de 2019 - 19:02
Como vocês tem acompanhado, o conteúdo do blog está recheado, e por isso, pensamos que um quizz seria interessante para rever alguns conceitos, tópicos importantes e até arriscar em alguns cálculos, que são parte muito importante dentro da temática Equilíbrio Ácido-Básico.
Esse quizz será feito em duas partes, a primeira, com essa postagem contendo seis questões, e outra postagem, com mais seis questões, que será liberada na semana que vem.
Ao fim do quizz, constará o gabarito, mas para seu aprendizado, faça todas as questões antes de olhar a resposta. Se tiverem alguma dúvida, comentem no post, que te ajudaremos!
Agora é com você!


1. Qual o principal tampão no organismo?
a) Fosfato
b) Bicarbonato
c) Amônia
d) Proteína
2. Quais os três sistemas regulatórios do nosso organismo?
a) Renal, respiratório e tampões
b) Renal, digestório e tampões
c) Digestório, respiratório e cardiovascular
d) Cardiovascular, digestório e tampões
3. Um indivíduo foi reportado pelo médico de que estava com acidose metabólica, o que significa que seu pH estava abaixo de 7,35. Qual será a resposta do organismo para restabelecer o equilíbrio ácido-básico?
a) Eliminação excessiva de dióxido de carbono pelos pulmões, causando hiperventilação
b) Retenção ou produção excessiva de dióxido de carbono pelos pulmões, causando hipoventilação
c) Excreção excessiva de bicarbonato pelos rins
d) Retenção ou produção excessiva de bicarbonato
4. Sobre o equilíbrio ácido-base, é correto afirmar que
a) O mecanismo respiratório para regular o equilíbrio ácido-base é muito lento, demorando horas para iniciar sua correção, sendo este pouco eficiente
b) Somente o mecanismo metabólico pode induzir uma acidose
c) Se uma acidose, onde o pH é inferior a 7,35, estiver acompanhada de uma PaCO2 superior a 45 mmHg, estaremos diante de uma acidose respiratória
d) A elevação do bicarbonato no sangue causa acidose ou neutraliza uma alcalose.
e) Quando a acidose ocorre com a PaCO2 normal e o bicarbonato baixo, estamos diante de uma acidose respiratória.
5. Qual o pH de uma solução 0.100M de ácido acético? (pka = 4.74)
6. O ácido lático (HC3H5O3) tem um hidrogênio ácido. Uma solução de 0,1mol/L de ácido lático tem um pH de 2,44. Calcule o Ka.
1. B
2. A
3. A
Alcalose metabólica: pH maior que 7,45; retenção ou produção excessiva de bicarbonato (mais de 28mmol/L).
Acidose metabólica: pH menor que 7,35; excreção excessiva de bicarbonato pelos rins (menos de 20mmol/L).
Alcalose respiratória: pH maior que 7,45; eliminação excessiva de dióxido de carbono pelos pulmões, causando hiperventilação (menos de 35 PCO2).
Acidose respiratória: pH menor de 7,35; retenção ou produção excessiva de dióxido de carbono pelos pulmões, causando hipoventilação (mais de 45 PCO2).
4. C
5. pH 2.9 (resolução na foto abaixo)
6. 1,4x10^-4 (resolução na foto abaixo)
__________
__________
INTERESSANTE! É POSSÍVEL USAR EXTRATO DE REPOLHO ROXO COMO INDICADOR UNIVERSAL DE pH
Geovanna C. Mariosi da Silva, 27 de julho de 2019 - 17:42
Lembra da nossa última postagem, sobre indicadores de pH obtidos a partir de plantas? Pois é, não é só da beterraba que se pode fazer um indicador de pH; além dela, podemos usar muitas outras plantas, inclusive o repolho-roxo! O Grupo de Pesquisa em Educação Química, do Instituto de Química - USP, desenvolveu um manual de aula prática para que você possa reproduzir esse experimento em sala de aula. Nesse material, você tem acesso a todos os materiais necessários, bem como todos os passos detalhados pra que o procedimento dê certo, para então, ter a demonstração do efeito tampão de comprimidos efervescentes com o extrato de repolho-roxo produzido por vocês mesmo!
E mão na massa!
ALERTA ARTIGO!
VOCÊ SABIA QUE EXISTEM INDICADORES DE pH FEITOS A PARTIR DE EXTRATOS DE PLANTAS?
Geovanna C. Mariosi da Silva, 27 de julho de 2019 - 17:20VOCÊ SABIA QUE EXISTEM INDICADORES DE pH FEITOS A PARTIR DE EXTRATOS DE PLANTAS?
Você já ouviu falar em indicadores de pH? São substâncias que mudam de cor, de acordo com suas características físico-químicas, e é a partir dessa mudança de cor que podemos inferir sobre nosso problema em questão, utilizando cálculos, por meio da titulação. Nesse processo, uma alternativa muito interessante é uso de corantes naturais que mudam de cor com a variação do pH, principalmente para aulas práticas.
A beterraba é um exemplo de planta alimentícia que pode ser usada para esse fim, pois os extratos dessa hortaliça apresentam colorações diferentes quando estão em meio ácido ou básico; a parte utilizada é a raiz tuberosa, que ter a cor vermelho-arroxeada, pela presença dos pigmentos hidrossolúveis, as betalaínas, que são divididas em duas classes: a betacianina, que é responsável pela coloração avermelhada, e a betaxantina, responsável pela coloração amarelada, que caracteriza a coloração típica das raízes de beterraba. Nessa imagem, podemos ver as diferentes colorações com a variação do pH.
Ficou curioso? No artigo a seguir, é possível aprofundar o conhecimento sobre os conceitos aqui citados, além de acompanhar, detalhadamente, como se dá a eficácia da utilização da beterraba como indicadora de pH, além de sua comparação com outros métodos.
Boa leitura, e até mais!
Referências bibliográficas:
CUCHINSKI, Ariela Suzan; CAETANO, Josiane; DRAGUNSKI, Douglas C.. Extração do corante da beterraba (Beta vulgaris) para utilização como indicador ácido-base. Eclética Química, [s.l.], v. 35, n. 4, p.17-23, 2010. FapUNIFESP (SciELO).
__________
__________
ALERTA VÍDEO!
DESMISTIFICANDO OS IMPACTOS DA ACIDIFICAÇÃO DOS OCEANOS E DA BIODIVERSIDADE
Andressa Garcia, 27 de julho de 2019 - 08:21DESMISTIFICANDO OS IMPACTOS DA ACIDIFICAÇÃO DOS OCEANOS E DA BIODIVERSIDADE
O vídeo abaixo apresenta o motivo da acidez dos oceanos, de uma forma interativa e didática, com desenhos para explicar o conteúdo e demonstrando o resultado que o meio ácido pode trazer a vinha marinha.
Referências Bibliográficas:
/https://pt.khanacademy.org/
__________
INTERESSANTE!
SAIBA MAIS SOBRE O CONTROLE DO pH EM MAMÍFEROS
Andressa Garcia, 27 de julho de 2019 - 04:07
Nesse link a seguir, é possível aprofundar o conteúdo de equilibro ácido-básico, de maneira didática, e evidenciando pontos importantes, como a alteração e os mecanismos no equilíbrio ácido-básico, os tampões no organismo, entre outros.

Se interessou? é só clicar nesse link!
Até mais!
__________
ALERTA ARTIGO!
ANÁLISE DA ACIDOSE EM CABRITAS RECÉM NASCIDAS, PARA PARÂMETROS GASOMÉTRICOS E ÁCIDO-BÁSICOS
Andressa Garcia, 26 de julho de 2019 - 12:11
ANÁLISE DA ACIDOSE EM CABRITAS RECÉM NASCIDAS, PARA PARÂMETROS GASOMÉTRICOS E ÁCIDO-BÁSICOS
Andressa Garcia, 26 de julho de 2019 - 12:11
O artigo "Parâmetros hemogasométricos e equilíbrio ácido-básico de cabritos nascidos de partos normais", realizado por Diego Camargo, traz um estudo muito relevante sobre o tema equilíbrio ácido-básico, realizando uma análise da acidose em cabritas recém nascidas, para obter os parâmetros gasométricos e ácido-básicos desses animais. Dessa forma efetuando esses testes foi observado uma elevada acidose nos recém nascidos em sua primeira 24h de vida, normalizando após esse período.
Referências bibliográficas:
CAMARGO, Diogo G. et al. Parâmetros hemogasométricos e equilíbrio ácido-básico de cabritos nascidos de partos normais. Pesquisa Veterinária Brasileira, [s.l.], v. 32, n. 1, p.09-14, dez. 2012. FapUNIFESP (SciELO).
__________
ALERTA VÍDEO!
EQUILÍBRIO ÁCIDO-BÁSICO ABORDADO PELOS SISTEMAS RENAL, URINÁRIO E EXCRETOR
Bruna Brantes, 25 de julho de 2019 - 19:11
Além da linguagem descomplicada, o layout simples e limpo facilita o entendimento.
Vale a pena assistir! :)
__________
ALERTA ARTIGO!
SISTEMA TAMPÃO, RINS E PULMÕES: OS HERÓIS DO EQUILÍBRIO ÁCIDO-BÁSICO SANGUÍNEO
Bruna Brantes, 25 de julho de 2019 - 18:14
SISTEMA TAMPÃO, RINS E PULMÕES: OS HERÓIS DO EQUILÍBRIO ÁCIDO-BÁSICO SANGUÍNEO
Bruna Brantes, 25 de julho de 2019 - 18:14
Uma propriedade muito importante do sangue é valor do pH. A escala de pH varia entre 0 (fortemente ácido) e 14 (fortemente alcalino). O sangue humano é levemente básico, com pH na faixa entre 7,35 a 7,45.
A alcalinidade do sangue aumenta quando os níveis de ácido no corpo diminuem ou quando os níveis de base aumentam.
Já a acidez do sangue aumenta quando os níveis de ácido aumentam ou quando os níveis de base diminuem.
O equilíbrio do corpo entre acidez e alcalinidade - que é de extrema importância, visto que um pequeno desvio da faixa normal de pH pode afetar gravemente o funcionamento do metabolismo - é denominado equilíbrio ácido-base.
O corpo utiliza mecanismos diferentes para controlar esse equilíbrio no sangue, que envolvem os rins, os pulmões e o sistema de tampão.
Os rins atuam na excreção dos ácidos ou bases em excesso;
Os pulmões (juntamente com o cérebro) atuam no ajuste da velocidade e profundidade da respiração, quanto mais rápido e mais profundo respirarmos, mais o pH sanguíneo aumenta;
Já o sistema de tampão é um processo químico, eficiente, e protege o corpo contra as alterações repentinas de acidez ou alcalinidade.
O sistema de tamponamento de pH mais importante no sangue envolve o ácido carbônico (um ácido fraco formado a partir do dióxido de carbono dissolvido no sangue) e os íons de bicarbonato (a base fraca correspondente).
Para uma melhor compreensão do assunto, sugiro a leitura do artigo abaixo, cujo objetivo era a avaliação das possíveis alterações no equilíbrio ácido-base de equinos da raça Quarto de Milha em um experimento envolvendo um circuito de 130m chamado de Prova dos 3 Tambores, onde o cavalo juntamente com o cavaleiro precisa finalizar o circuito contornando os tambores, no menor tempo possível.
Sabe-se que o eflúvio máximo de CO2 ocorre durante os primeiros 30 segundos do exercício de intensidades alta, portanto o exercício intenso realizado na P3T seria determinante da acidose metabólica e da ativação dos mecanismos de regulação da hemostasia.
Além dos resultados importantes obtidos, o artigo traz definições, tais como: o que é tampão? Como funciona o equilíbrio ácido-base? Como é formado o lactato? entre outros, ou seja, vale muito a pena a leitura :)
Referências Bibliográficas:
SILVA, Marco Augusto Giannoccaro da et al. Equilíbrio ácido-base em equinos da raça quarto de milha participantes da prova dos três tambores. Revista Brasileira de Medicina Veterinária, Araguaína, v. 35, n. 2, p.188-192, 17 jun. 2013.
__________
ACIDOSE: METABÓLICA OU RESPIRATÓRIA
Bruna Brantes, 25 de julho de 2019 - 16:42
A acidose é provocada por um excesso de produção de ácido que se acumula no sangue ou por uma perda excessiva de bicarbonato no sangue (acidose metabólica) ou por um acúmulo de dióxido de carbono no sangue decorrente de função pulmonar insuficiente ou de interrupção da respiração (acidose respiratória).
Se um aumento de ácido supera os sistemas de controle ácido-base do corpo, o sangue se torna ácido. Quando o pH sanguíneo diminui (torna-se mais ácido), as partes do cérebro que regulam a respiração são estimuladas a produzir uma respiração mais rápida e profunda (compensação respiratória). A respiração mais rápida e profunda aumenta a quantidade de dióxido de carbono exalado.
Também os rins tentam compensar o pH pela excreção de mais ácido na urina. Porém, ambos os mecanismos podem ser superados se o corpo continuar produzindo excesso de ácido, resultando em acidose grave e podendo dar origem a problemas cardíacos e coma.
Acidose metabólica
A acidose metabólica surge quando a quantidade de ácido no corpo aumenta devido à ingestão de substância que é um ácido, ou que pode ser decomposta (metabolizada) em ácido — tal como o álcool de madeira (metanol), um anticongelante (etilenoglicol) ou grandes doses de aspirina (ácido acetilsalicílico). Muitos outros medicamentos e venenos podem causar acidose.
A acidose metabólica também pode ocorrer como resultado de metabolismo anormal. O corpo produz excesso de ácido nas fases avançadas de choque (acidose lática) e em diabetes mellitus tipo 1 mal controlado (cetoacidose diabética).
Mesmo uma produção de quantidades normais de ácido pode causar acidose quando os rins não estão funcionando normalmente (insuficiência renal) e são, portanto, incapazes de excretar quantidades suficientes de ácido na urina.
A acidose metabólica também ocorre quando o corpo perde uma quantidade excessiva de base. Por exemplo, pode ocorrer perda de bicarbonato através do trato digestivo, devido a diarreia ou ileostomia.
Acidose respiratória
A acidose respiratória surge quando os pulmões não expelem dióxido de carbono de forma adequada (ventilação inadequada), um problema que pode ocorrer em distúrbios que afetam gravemente os pulmões (como doença pulmonar obstrutiva crônica, pneumonia grave, insuficiência cardíaca e asma).
A acidose respiratória também pode surgir quando distúrbios do cérebro, dos nervos ou dos músculos do tórax (como a síndrome de Guillain-Barré ou a esclerose lateral amiotrófica) dificultam a respiração. Além disso, é possível que uma pessoa desenvolva acidose respiratória quando ocorre lentificação da respiração devido a sedação excessiva por opioides (narcóticos), álcool ou medicamentos fortes que induzem o sono (sedativos). Como resultado da lentidão da respiração, o nível de oxigênio no sangue pode ser baixo.
A respiração afetada por distúrbios do sono (por exemplo, apneia do sono) pode fazer com que a pessoa pare de respirar por tempo suficiente para causar acidose respiratória.
Referências bibliográficas:
https://www.msdmanuals.com/pt-br/casa/distúrbios-hormonais-e-metabólicos/equilíbrio-ácido-base/acidose
__________
VOCÊ SABIA QUE SEM O EQUILÍBRIO ÁCIDO-BÁSICO NÃO SERIA POSSÍVEL SOBREVIVER?
Geovanna C. Mariosi da Silva, 25 de julho de 2019 - 08:15
Você já ouvi falar em equilíbrio ácido-básico? Se não, provavelmente você não faz ideia da importância que ele exerce no controle na nossa homeostasia - "homeostasia, o que é isso?!" - calma, a gente te explica! Homeostasia é o processo de regulação que os organismos mantém para sempre equilibrar seu organismo. Mas, pera aí, e onde o equilíbrio ácido-básico entra nessa história? É justamente na homeostasia. Podemos considerar o equilíbrio ácido-básico como um dos milhares de processos que acontecem nos organismos, para mantê-los funcionando; ele não é melhor nem pior que os outros, mas é essencial, e sem ele a manutenção da vida ficaria em deficit. Bom, mas afinal, o que faz esse tal equilíbrio? Bom, inicialmente, vamos tratar desse equilíbrio com relação ao sangue, para facilitar a compreensão, mas também pode se aplicar a outros tecidos - apesar de se tratar do sangue, isso também acaba influenciando no funcionamento de outros tecidos. Para que nossas células, proteínas e demais estruturas funcionem de maneira adequada, há um arcabouço de produtos que nosso sistema necessita, em concentração também adequada; um desses produtos, é o íon H+, que são capazes de acidificar o meio, quando são liberados, ou então alcalinizar o meio, quando são retirados. Quando falamos de íons H+, o colocamos em forma de pH, para facilitar a compreensão dos processos. O nosso sangue tem uma faixa específica de pH para que a homeostase funcione adequadamente, que vai de 7,35 a 7,45, dessa forma, quando há variação das concentrações de íons H+ fora desse intervalo, começam a surgir problemas para as nossas células, pois elas deixaram de funcionar adequadamente. Quando o pH está acima de 7, 35, temos a condição de alcalose; quando o pH está abaixo de 7,35, temos a condição de acidose; ambas as condições podem ser metabólicas (relacionadas aos rins), ou respiratórias (relacionadas aos pulmões).
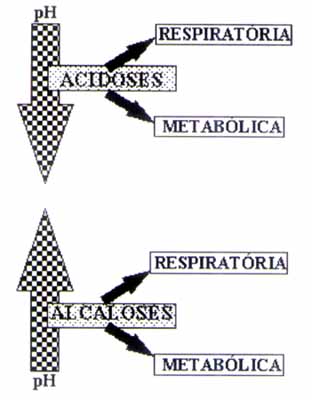
Os limites críticos que o indivíduo pode alcançar são de pH 6,85, para a acidose, e de pH 7,95, para alcalose; fora desses intervalos, pode vir a óbito. Mas, calma, que não é tão fácil assim de sair desses intervalos! Pra isso, os organismos, ao longo do processo evolutivo, desenvolveram mecanismos de controlar a concentração de íons H+, fazendo então, o equilíbrio ácido-básico.

Curtiu o tema? tem alguma dúvida? Escreva pra gente, comentando o que achou. Esse post é destinado a abrir a temática do Equilíbrio Ácido-Básico dentro do blog de Biofísica, e ao longo dos próximos dias postaremos muito mais sobre, desde artigos científicos e links interessantes, até quizz para testar como anda seu conhecimento sobre o tema.
Referências bibliográficas:
FURONI, Renato Marinho et al. Distúrbios do equilíbrio ácido-básico. Faculdade de Ciências Médicas de Sorocaba, Sorocaba, v. 12, n. 1, p.5-12, 18 fev. 2010.





Comentários
Postar um comentário